Vincenzo Menghini (continua)
|
|
|
| Fig. 1:
E.F. Hoppe-Seyler,
medico tedesco (1825-1895). Riuscì ad ottenere l'emoglobina in forma
cristallina e ne spiegò il funzionamento. (Credit: Today in Science History) |
|
|
|
| Fig.
2:
Max Perutz (1914-2002) e John F. Kendrew (1917-1977), vincitori del Nobel
per la Chimica 1962 per aver individuato la struttura tridimensionale
dell'emoglobina e della mioglobina. (Credit: Nobelprize.org) |
Lo sforzo
per stabilire la struttura dell'emoglobina mediante la cristallografia a raggi X
impegnò duramente per circa 30 anni al Laboratorio Cavendish di Cambridge il
chimico Max Perutz e collaboratori. Perutz giunse ad ottenere la struttura
della metaemoglobina di cavallo nel 1968. Alcuni anni prima (1962) in
riconoscimento dei suoi meriti nel campo della biologia strutturale gli fu
conferito il Nobel per la chimica. Lo condivise con Kendrew che si era occupato
della mioglobina, l'equivalente dell'emoglobina che si trova nei muscoli.
L'emoglobina dei mammiferi è una proteina composta di catene, due alfa e due
beta. Si dice che è un tetramero con una struttura quaternaria
![]() 2
2![]() 2.
Ciascuna ha un anello, detto eme, contenente uno ione Fe(II) chimicamente
coordinato. L'ossigeno si lega reversibilmente agli atomi di ferro, introducendo
una modificazione nella struttura dell'emoglobina. In pratica l'emoglobina si
comporta come una macchina molecolare che trasporta l'ossigeno dai polmoni ai
siti di utilizzazione e da qui preleva il diossido di carbonio (come ione HCO3-)
per eliminarlo con l'espirazione polmonare. L'ossigeno non si lega
contemporaneamente ai quattro gruppi, ma con un meccanismo tale da permettere
all'emoglobina di assumerne dai polmoni la massima quantità possibile e di
rilasciarla quando e dove è più necessaria.
2.
Ciascuna ha un anello, detto eme, contenente uno ione Fe(II) chimicamente
coordinato. L'ossigeno si lega reversibilmente agli atomi di ferro, introducendo
una modificazione nella struttura dell'emoglobina. In pratica l'emoglobina si
comporta come una macchina molecolare che trasporta l'ossigeno dai polmoni ai
siti di utilizzazione e da qui preleva il diossido di carbonio (come ione HCO3-)
per eliminarlo con l'espirazione polmonare. L'ossigeno non si lega
contemporaneamente ai quattro gruppi, ma con un meccanismo tale da permettere
all'emoglobina di assumerne dai polmoni la massima quantità possibile e di
rilasciarla quando e dove è più necessaria.
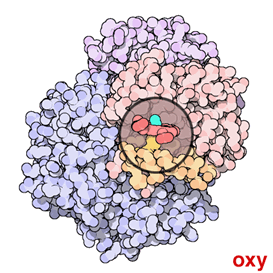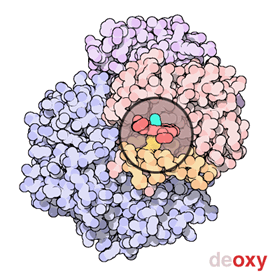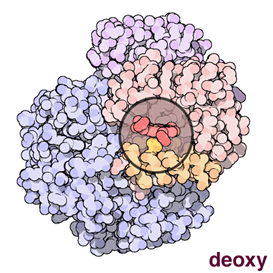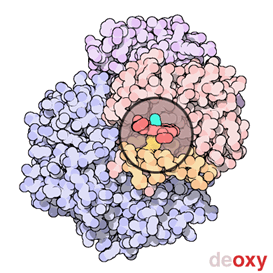 Fig. 3: Immagine animata dell'emoglobina. (Credit: RCSB PDB-Protein Data Bank) |
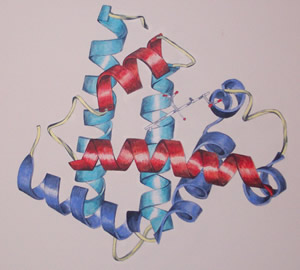 Fig. 4: Rappresentazione della mioglobina. (Credit: RCSB PDB-Protein Data Bank) |
 Fig. 5: Uno scorcio di Budrio. (Credit: Foto di Vittorio Bonaga) |
A Menghini vennero parecchi, autorevoli, riconoscimenti. Basti ricordare che il celebre dizionario di chimica di Macquer (1778), riferendo le conoscenze sul ferro nel sangue, così si esprime: "Ma il primo che ha fatto delle ricerche coerenti su questo argomento, sembra essere il Sig. Menghini, il quale ha dimostrato non solo che il sangue contiene molto ferro, soprattutto nella parte rossa; ma anche che le preparazioni contenenti questo metallo, una volta ingerite, passano prevalentemente nelle seconde vie, provocano vari cambiamenti nel sangue, e possono risultare all'analisi. Le esperienze di questo medico sono molto belle e assai soddisfacenti". È giusto quindi che Menghini, scienziato un po' dimenticato, venga riscoperto dai giovani, insieme (perché no?) ai toni soft and hollow degli strumenti musicali di Budrio.
|
|
(Vincenzo
Menghini - pagina 4 di 4)
< Indietro | |